中心原子结合的原子数是什么
中心原子结合的原子数是该原子连接两个或两个以上原子,就属于中心原子,该原子只连一个原子,就不是中心原子。
原子数为某元素于非单原子状态(分子或化合物)时的数目,在化学式中写在元素符号的右下方。
原子由带正电荷的原子核和在原子核的库仑场中运动的带负电的电子组成。
大学化学基础知识点
1、配位数是指与中心原子直接键合的配位原子数。 配体数是分子组成中与中心原子结合的配体的数目。 因为有的配体只有一个配位原子,那么就叫单齿配体,有的配体中配位原子不止一个,就叫多齿配体。所谓齿即配位原子数。 2、单齿配体的数目与配位原子数相等,即:配体数 = 配位数 多齿配体的配体数与配位数不相等,即:配体数 ≠ 配位数 3、实例 Cu(NH3)4 2+ Cu(en)2 2+ (en: NH2-CH2-CH2-NH2 ) 配体: NH3 NH2-CH2-CH2-NH2 单齿配体 双齿配体 配位原子: N N 配体数: 4 2 配位数: 4 4
怎么计算分子中原子的个数
孤对电子数=1/2*(a-xb)。
其中,a为中心原子的价电子数,x为与中心原子结合的原子数,b为中心原子结合的原子最多能接受的电子数。
例如:H₂O的中心原子是氧,a是氧的最外层电子数6,x是配对原子个数2,b是配对原子还可以容纳的电子数为1。根据计算公式,1/2*(6-2×1)=2,孤对电子数为2。
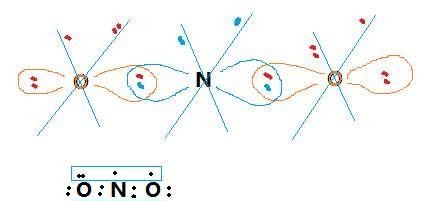
举例说明
例如,氨分子的氮原子上有一对孤对电子;水分子的氧原子上有两对孤对电子等。由于孤对电子的电子云比成键电子对在空间的伸展大,对成键电子有更强的排斥作用,致使分子的键角减少。
如甲烷无孤对电子,键角为109.5℃,而氨和水分子的键角分别为107°和104.5°。在描述分子几何构型时,不包括孤对电子,故甲烷分子为四面体;氨分子为三角锥形而水分子则为弯曲形。
杂化轨道数等于什么
杂化轨道数=中心原子孤电子对数+中心原子结合的原子数
孤电子对数=1/2(a-xb)
a:中心原子价电子数;
x:与中心原子成键的原子数;
b:中心原子所结合的原子所能接收的电子数。
以CH4为例,CH4中C原子上孤电子对数=1/2(4-4*1)=0
因为杂化轨道数=中心原子孤电子对数+中心原子结合的原子数
所以中心原子的杂化轨道数为0+4=4
所以是sp3杂化。【sp3的含义是中心原子把s轨道和3个p轨道(p轨道有三个px py pz呈哑铃型,或称纺锤形)掺到一起,重新分为能量均等的四个轨道】
sp、sp2神马的都是相似的。
【 HgI2中心原子价电子数=1/2(2-2*1)=0
杂化轨道数=0+2
所以采取的是sp杂化】
求孤电子对的时候,需要注意,
①如果该微粒为阳离子,a为中心原子价电子数-离子所带电荷数
阴离子,aa中心原子价电子数+离子所带电荷数的绝对值
②sp、sp2杂化中还有未参与杂化的p轨道,可以被用来形成π键,而杂化轨道只适用于形成σ键或者用来容纳未参与成键的孤电子对。
硝酸里中心原子结合的原子数是多少啊
硝酸中心原子是氮,三个氧原子在氮周围,所以中心原子结合三个原子。硝酸可以写成HONO2,意为氢与氧相连。硝酸根离子中,离子构型为平面正三角形,三个氧位于等边三角形的三个顶点上
以上就是关于大学化学基础知识点,中心原子结合的原子数是什么的全部内容,以及中心原子结合的原子数是什么的相关内容,希望能够帮到您。
版权声明:本文来自用户投稿,不代表【易百科】立场,本平台所发表的文章、图片属于原权利人所有,因客观原因,或会存在不当使用的情况,非恶意侵犯原权利人相关权益,敬请相关权利人谅解并与我们联系(邮箱:350149276@qq.com)我们将及时处理,共同维护良好的网络创作环境。





