制二氧化碳为什么不能用稀硫酸
制二氧化碳不能用稀硫酸的原因是稀硫酸会和碳酸钙反应生成微溶的硫酸钙,覆盖在碳酸钙的表面,阻止反应继续进行。
稀硫酸是指溶质质量分数小于或等于70%的硫酸的水溶液,由于稀硫酸中的硫酸分子已经被完全电离,所以稀硫酸不具有浓硫酸的强氧化性、吸水性、脱水性等特殊化学性质。
实验室制取二氧化碳不用稀硫酸的原因是什么
实验室制取二氧化碳不用稀硫酸的原因如下:
稀硫酸与碳酸钙反应生成的硫酸钙是微溶于水的物质,会覆盖在石灰石的表面,阻止反应的进行。因此,在实验室制取二氧化碳时,通常不使用稀硫酸。
硫酸(化学式:H₂SO₄),硫的最重要的含氧酸。无水硫酸为无色油状液体,10.36℃时结晶,通常使用的是它的各种不同浓度的水溶液,用塔式法和接触法制取。前者所得为粗制稀硫酸,质量分数一般在75%左右;后者可得质量分数98.3%的纯浓硫酸,沸点338℃,相对密度1.84。
稀硫酸是指溶质质量分数小于或等于70%的硫酸的水溶液。由于稀硫酸中的硫酸分子已经被完全电离,所以稀硫酸不具有浓硫酸的强氧化性、吸水性、脱水性(俗称碳化,即强腐蚀性)等特殊化学性质。
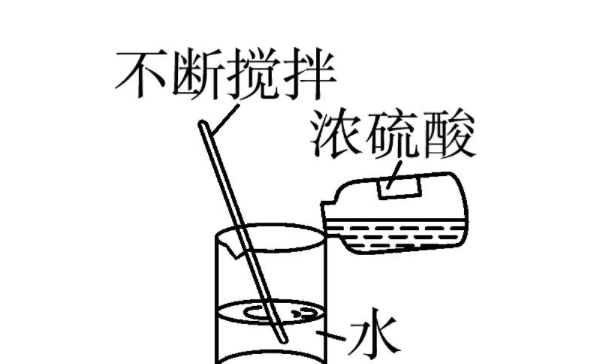
浓硫酸是指常温下无色无味透明液体,密度比水大,常用浓硫酸浓度为98%,密度为1.84g/cm³。浓硫酸稀释的应当用玻璃棒将浓硫酸倒入水中,并且要不停的搅拌,以释放化学反应产生的热量,如果发热严重,用凉水或冰水降温,然后稀释到需要的比例或体积就可以了。
制取二氧化碳的步骤一般包括:
1、连接装置并检查装置的气密性。
2、加入药品,一般为大理石或石灰石与稀盐酸。
3、将试管稳定在铁架台上,如果使用广口瓶或锥形瓶,则无此步骤。
4、收集气体,通常使用向上排空气法。
5、用燃着的木条放在集气瓶口验满。
智取二氧化碳为什么不能用稀硫酸
一般制取二氧化碳是用碳酸钙和稀盐酸为原料,不用稀硫酸的原因是稀硫酸与碳酸钙反应生成硫酸钙,硫酸钙是一个微溶物质包裹在未发生化学反应的碳酸钙的表面,阻止碳酸钙和稀硫酸继续反应。
实验室制取二氧化碳的原理:CaCO3+2HCl=CaCl2+H2O+CO2
实验装置:
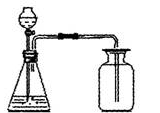
收集方法:
用向上排空气法收集二氧化碳(因为二氧化碳密度比空气大)。不能用排水法收集二氧化碳(因为二氧化碳溶于水)。
实验室制取二氧化碳:
(一)选用大理石或石灰石制取二氧化碳原因
答:大理石或石灰石的主要成分是碳酸钙。碳酸盐跟酸起反应,一般都有二氧化碳生成。若选用可溶性的碳酸盐(如碳酸钠等),与酸反应速度过快,难以控制;若选用不溶性碳酸盐(如碳酸镁等),则其来源一般较少。大理石或石灰石与酸反应适中,其在自然界中含量也极其丰富,价格低廉。所以,选用大理石或石灰石制二氧化碳。
(二)实验室制取二氧化碳时,最好选用稀盐酸原因
答:如果用稀硫酸和大理石或石灰石反应,有关化学方程式为:CaCO3+H2SO4=CaSO4+H2O+CO2↑,结果生成微溶性固体硫酸钙,它覆盖在大理石或石灰石表面,使酸与大理石或石灰石脱离接触,导致反应太缓慢。
如果用硝酸与大理石或石灰石反应,由于硝酸是一种不稳定性的酸,在见光或受热时易分解:4HNO3=4NO2↑+O2↑+2H2O,从而使制得的CO2中混有NO2和O2等杂质。
如果用浓盐酸和大理石或石灰石反应,由于浓盐酸具有挥发性,使制得的CO2中混有较多的氯化氢气体。
用稀盐酸和大理石或石灰石反应,所得CO2气体平稳,气体又较为纯净,所以选用稀盐酸制CO2最合适。
以上就是关于制二氧化碳为什么不能用稀硫酸的全部内容,以及制二氧化碳为什么不能用稀硫酸的相关内容,希望能够帮到您。
版权声明:本文来自用户投稿,不代表【易百科】立场,本平台所发表的文章、图片属于原权利人所有,因客观原因,或会存在不当使用的情况,非恶意侵犯原权利人相关权益,敬请相关权利人谅解并与我们联系(邮箱:350149276@qq.com)我们将及时处理,共同维护良好的网络创作环境。