磷酸为什么是二元酸
磷酸是偏磷酸,酸根是HPO3,一个偏磷酸分子能电离出两个氢离子,也就是说在水溶液中能提供两个质子。HPO3是不能够进一步电离的,因此磷酸是一种二元酸。
磷酸,化学式H3PO4,分子量为97.994,是一种常见的无机酸,是中强酸。由五氧化二磷溶于热水中得到。正磷酸工业上用硫酸处理磷灰石制得。磷酸在空气中容易潮解,加热会失水得到焦磷酸,再进一步失水得到偏磷酸。磷酸主要用于制药、食品、肥料等工业,包括作为防锈剂,食品添加剂,牙科和矫形外科,EDIC腐蚀剂,电解质,助焊剂,分散剂,工业腐蚀剂,肥料的原料和组件家居清洁产品,也可用作化学试剂,磷酸盐是所有生命形式的营养。
无机化学
看结构式,中只有与O链接的H才能电离
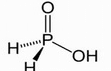
一元酸
四元酸
磷酸是几元酸,为什么
磷酸是三元弱酸。
看酸为几元酸需要看该酸的一个分子自身可以在水中电离出厂个H+。可以电离出一个H+的酸就是一元酸,可以电离出两个H+的酸就是二元酸,可以电离出3个H+的就是三元酸。而磷酸的分子式为H3PO3,可以电离出三个H+,故为三元酸。
磷酸pH值和溶液的浓度有关,没有具体的浓度值是无法直接给出准确的pH值数值的。[H+]是溶液中氢离子的活度(有时也被写为[H3O+],水合氢离子活度)也是PH值的定义的重要依据,单位为摩尔/升,在稀溶液中,氢离子活度约等于氢离子的浓度,可以用氢离子浓度来进行近似计算。

磷酸概述:
正磷酸是由一个单一的磷氧四面体构成的磷酸。在磷酸分子中P原子是sp3杂化的,3个杂化轨道与氧原子间形成3个σ键,另一个P—O键是由一个从磷到氧的σ配键和两个由氧到磷的d-p配键组成的。σ配键是磷原子上的一对孤对电子向氧原子的空轨道配位而形成。
d←p配键是氧原子的py、pz轨道上的两对孤对电子和磷原子的dxz、dyz空轨道重叠而成。由于磷原子3d能级比氧原子的2p能级能量高很多。
组成的分子轨道不是很有效的,所以P—O键从数目上来看是三重键,但从键能和键长来看是介于单键和双键之间。纯H3PO4和它的晶体水合物中都有氢键存在,这可能是磷酸浓溶液粘稠的原因。
以上内容参考:
h3po3为什么是二元酸
亚磷酸 化学式H3PO3,是磷(Ⅲ)的含氧酸。通常是无色晶体,有大蒜气味,熔点为736℃,相对密度为1.651(21.2℃)。在200℃时分解成磷化氢和正磷酸。吸湿性极强,易溶于水,也易溶于乙醇。暴露于空气中可渐渐被氧化成正磷酸。亚磷酸的化学式中虽有3个氢原子,但在水中只能离解出2个氢离子。它是二元酸,其强度近于次强酸(K1=1.6×10-2,K2=7×10-7)。它有两类盐,酸式盐(如NaH[PHO3])和正盐(如Na2[PHO3]),除碱金属盐以外,多数盐难溶于水。亚磷酸具有强还原性,能将银离子还原成单质银;把二价汞离子还原成一价汞离子或汞,如:
HgCl2+H2[PHO3]+H2O=H3PO4+Hg+2HCl
可把亚硫酸还原成单质硫等。亚磷酸通常用做化学试剂、还原剂,并供制亚磷酸盐。亚磷酸的氧化性不明显,但在200℃时发生如下歧化反应:
4H2[PHO3]=3H3PO4+PH3
亚磷酸可由三氯化磷水解,所得溶液在低温下蒸去盐酸,脱水冷却而制得:
PCl3+3H2O=H3PO3+3HCl
也可由六氧化四磷缓慢同水作用而得。
h3po3为什么是二元酸方程式
稳定的亚磷酸是把磷酸的一个羟基用氢原子替换,而这个与磷原子直接相连的氢原子不能够电离,所以亚磷酸是二元酸。
判断酸是几元酸,要看其中的氢原子能否电离为氢离子,能电离几个就是几元酸。而无机酸中能电离出来的氢都是羟基(羟基是-OH,横线表示未成对电子)上的氢。亚磷酸中有两个羟基,另外一个氧和一个氢分别以配位键和单键与磷原子直接相连,故亚磷酸为二元酸。

亚磷酸性质
在空气中缓慢氧化成正磷酸,加热到180℃时分解成正磷酸和磷化氢(剧毒)。亚磷酸为二元酸,其酸性比磷酸稍强,它具有强还原性,容易将Ag离子还原成金属银,能将硫酸还原成二氧化硫。
有强吸湿性和潮解性,有腐蚀性。能引起灼伤,对皮肤有刺激性。放置于空气中即潮解,易溶于水。高于160℃分解,生成H3PO4和PH3。
以上内容参考:
以上就是关于无机化学,磷酸为什么是二元酸的全部内容,以及磷酸为什么是二元酸的相关内容,希望能够帮到您。
版权声明:本文来自用户投稿,不代表【易百科】立场,本平台所发表的文章、图片属于原权利人所有,因客观原因,或会存在不当使用的情况,非恶意侵犯原权利人相关权益,敬请相关权利人谅解并与我们联系(邮箱:350149276@qq.com)我们将及时处理,共同维护良好的网络创作环境。







