什么是阳离子和阴离子
阳离子是指原子由于外界作用失去一个或几个电子,使其最外层电子数达到8个或2个电子的稳定结构。
原子半径越大的原子其失电子能力越强,金属性也就越强。
金属性最强的金属元素是钫(Fr)。
阴离子是指原子由于自身的吸引作用从外界吸引到一个或几个电子使其最外层电子数达到8个或2个电子的稳定结构。
半径越小的原子其吸收电子的能力也就越强,就越容易形成阴离子,非金属性就越强。
非金属性最强元素是氟。
要是光不知道阴阳离子的意义,那有个最简单的方法---看加减号,正为阳,负为阴。
细胞内外液主要阴阳离子是什么
阴离子是带负电荷的离子,阳离子是带正电的离子.
阴离子通常是非金属元素或多元素构成,如Clˉ离子、硝酸根离子.阳离子通常是金属元素构成的离子,如Na离子、Mg离子等等.
阳离子阴离子的区别秒懂百科
阳离子阴离子的区别如下:
阳离子和阴离子是化学中离子的两种基本类型。阳离子带正电荷,阴离子带负电荷。它们在各自的化学性质、形成方式以及在化合物中的作用有所不同。
1、阳离子的定义和特点
阳离子是指带有正电荷的离子,在化学式中通常以"+"符号表示。它是通过失去一个或多个电子而形成的。阳离子具有较小的半径和较高的电子亲和能力,喜欢与阴离子结合形成化合物。

2、阴离子的定义和特点
阴离子是指带有负电荷的离子,在化学式中通常以"-"符号表示。它是通过获得一个或多个电子而形成的。阴离子具有较大的半径和较低的电子亲和能力,喜欢与阳离子结合形成化合物。
3、形成方式
阳离子的形成通常源于金属原子,因为金属原子容易失去电子,形成正离子。金属原子的外层电子少,容易通过失去电子来达到稳定的电子结构。举例来说,钠原子可以失去一个电子,变成带正电荷的钠离子。
阴离子的形成通常源于非金属原子,因为非金属原子倾向于获得电子,形成负离子。非金属原子的外层电子多,容易通过获得电子来达到稳定的电子结构。举例来说,氯原子可以获得一个电子,变成带负电荷的氯离子。

4、化合物中的作用
在化合物中,阳离子和阴离子通过离子键相互结合形成离子晶体。离子晶体的稳定性来自于阳离子和阴离子之间的静电吸引力。阳离子和阴离子之间的化学键是由电子的转移而形成的,它们在离子晶体中以晶体格点的形式排列。
在溶液中,阳离子和阴离子的化学反应和离解性质也有所不同。通常情况下,阳离子在水中溶解时会与水分子形成水合离子,从而增加其溶解度。
5、常见阳离子和阴离子
在化学中,常见的阳离子包括钠离子(Na+)、铵离子(NH4+)、铜离子(Cu2+)等。这些离子带有正电荷,可以与阴离子形成稳定的化合物。
常见的阴离子包括氯离子(Cl-)、氢氧根离子(OH-)、硝酸根离子(NO3-)等。这些离子带有负电荷,可以与阳离子形成离子化合物。
什么是阳离子
1、带电性质不同
阳离子:带一个或多个正电荷的离子;
阴离子:带一个或多个负电荷的离子。
2、原理不同
阳离子:原子由于外界作用失去一个或几个电子,使其最外层电子数达到稳定结构。
阴离子:原子由于外界作用得到一个或几个电子,使其最外层电子数达到稳定结构。
3、最外层电子数不同
阳离子:原子核最外层电子数小于4;
阴离子:原子核最外层电子数大于4。
4、放电子的功能不同
阳离子:原子的半径愈大,原子的失电子能力较强,金属性也就较强。
阴离子:半径越小的原子,吸收电子的能力越强,非金属性就越强。
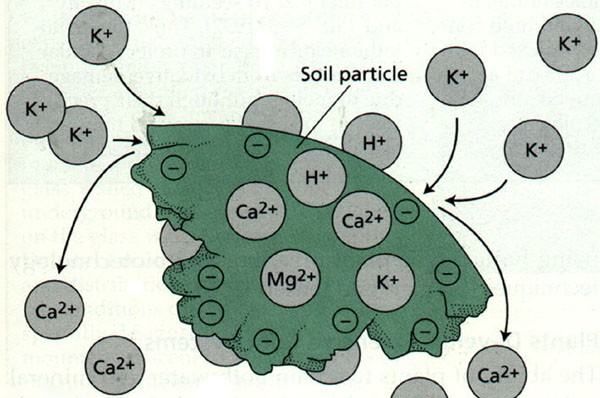
扩展资料
常见的阳离子有:Na⁺、K⁺ 、NH⁴⁺ 、Mg²⁺、Ca²⁺、Ba²⁺、Al³⁺、Fe²⁺、Fe³⁺、Zn²⁺、Cu²⁺、Ag⁺等。
常见阴离子有:SO₄²⁻、SiO₃²⁻、PO4³⁻、CO₃²⁻、SO₃²⁻、S2O₃²⁻、S²⁻、Cl⁻、Br⁻、I⁻、NO³⁻、NO²⁻、Ac⁻等。
在阴离子中,有的遇酸易分解,有的彼此氧化还原而不能共存。故阴离子的分析有以下两个特点:
(1)阴离子在分析过程中容易起变化,不易于进行手续繁多的系统分析。
(2)阴离子彼此共存的机会很少,且可利用的特效反应较多,有可能进行分别分析。
在阴离子的分析中,主要采用分别分析方法,只有在鉴定时,在某些阴离子发生相互干扰的情况下,才适当采取分离手段。
但采用分别分析方法,并不是要针对所研究的全部离子逐一进行检验,而是先通过初步实验,用消去法排除肯定不存在的阴离子,然后对可能存在的阴离子逐个加以确定。
以上就是关于什么是阳离子和阴离子,细胞内外液主要阴阳离子是什么的全部内容,以及什么是阳离子和阴离子的相关内容,希望能够帮到您。
版权声明:本文来自用户投稿,不代表【易百科】立场,本平台所发表的文章、图片属于原权利人所有,因客观原因,或会存在不当使用的情况,非恶意侵犯原权利人相关权益,敬请相关权利人谅解并与我们联系(邮箱:350149276@qq.com)我们将及时处理,共同维护良好的网络创作环境。