硝酸根为什么是sp2杂化
硝酸根之所以是sp2杂化是因为硝酸根的杂化类型是等性sp2杂化,硝酸根中氮和氧有双键,还有氮和氧的配位键。
硝酸根离子有氧化性,在酸性溶液中能使亚铁离子氧化成铁离子,而自己则还原为一氧化氮。
一氧化氮能跟许多金属盐结合生成不稳定的亚硝基化合物。
硝酸中氮原子的杂化轨道为什么是sp2杂化方式
只需要看硝酸根离子,首先带一个单位负电荷,氮周围有五个电子加上这个负电荷是六个,正好和三个氧原子形成三对双键。
单键,双键,三键,都只算一个轨道,所以是一个s+两个p,sp2
硝酸根离子为什么是sp2杂化
【硝酸根:NO₃⁻】
氮原子与每一个氧原子形成一个σ键,由于电子云互斥,三个σ键处于氮原子的平面正三角形三个方向,即SP2杂化。
除σ键外,氮原子还有一对未成对电子,占据一条p轨道。而三个氧各剩余一个未成键电子,也占据一条p轨道,四个p轨道互相平行,以“肩并肩”的形式构成四中心大π键。加上-1价电子(即从氢或金属等阳离子处夺取的电子),共6个电子,形成3个电子对,即四中心六电子大π键。
【氨分子:NH₃】
氮原子与每一个氧原子形成一个σ键,此时,氮原子还剩余一对未成键电子对。
但与硝酸根不同的是,氢原子不具有p轨道,因此不能形成π键。
由于电子云互斥,三个σ键与未成键电子对互相排斥,最终拉扯成变形四面体结构,即SP3杂化。
【硝酸根对比三氯化氮:NCl₃】
三氯化氮看上去与硝酸根类似,都是氮作为中心原子与三个其他原子成σ键,而且氯原子也同氧原子类似,具有p轨道。
但是,氮原子与三个氯原子成三个σ键之后,不论氮原子还是氯原子,它们的外层电子数都已经饱和,不能再互相共享π电子,因此也是形成不了π键的。
所以,氮原子的未成键电子对也会与三个σ键互相排斥,最终拉扯成变形四面体结构,即SP3杂化。
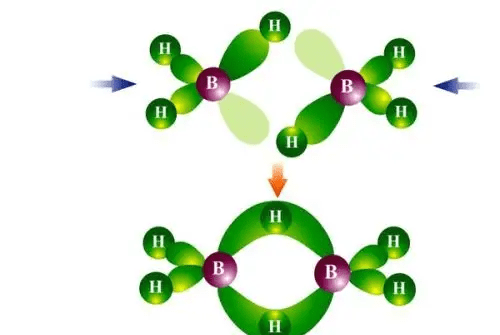
【氨分子对比氢化硼:BH₃】
氢化硼(甲硼烷)看上去与氨类似,都是中心原子与三个氢原子成σ键。
但它与氨不同的地方在于:硼外层只有3个电子,形成三个σ键后,没有了未成键电子对。
因此,电子云之间的互斥只发生在三个σ键之间,所以被拉扯成平面正三角形结构,即SP2杂化。
【注】
氢化硼中的硼原子SP2杂化并形成三个σ键后,还具有一个空的p轨道,对外界电子云具有强烈的吸引力,因此会吸引临近氢化硼的氢电子云。两个氢化硼分子互相吸引对方的氢电子云,以氢为桥梁(两个氢桥键),构成了B₂H₆(乙硼烷)形式的二聚型分子。这时候的硼就变成了SP3杂化。
硝酸根为什么是sp2 型杂化类型
那个叫V开头的什么理论,名字我忘了,但是还是记得其中的一种计算方法的,就是减法。具体步骤:(1)、将该离子团写成ABm的形式,如NH4+,先写成AB4的形式;(2)、把中心原子A的电子分配给B,使其达稳定结构(8个e或2个e),因此NH4+就是N分了4个e给4个H,N上本来有5个e,现在剩下一个。(3)、如果带电荷,如本题的离子团,正电荷的,上一步剩下的电子就减去所带的电荷数,负的,就加上所带电荷数。这步之后,剩余电子数为0,因此就没有孤对电子(用E表示孤对电子)存在。如果剩余的不为0,则将剩下的(也就是相当于减法所得到的答案)除以2,得不到整数的则进一。(4)、将上一步的结果用ABmEn表示出来,则m+n就是杂化轨道总数了,因此NH4+是AB4E0,4个杂化轨道,因此是SP3杂化。
应用:NO3-,AB3En,分配:5-2*3+1=0,因此n=0,也是没有孤对电子,即有3个杂化轨道,故为sp2杂化。
以上就是关于硝酸根为什么是sp2杂化的全部内容,以及硝酸根为什么是sp2杂化的相关内容,希望能够帮到您。
版权声明:本文来自用户投稿,不代表【易百科】立场,本平台所发表的文章、图片属于原权利人所有,因客观原因,或会存在不当使用的情况,非恶意侵犯原权利人相关权益,敬请相关权利人谅解并与我们联系(邮箱:350149276@qq.com)我们将及时处理,共同维护良好的网络创作环境。







