怎么判断离子共存问题
如果溶液中的某些离子之间能够反应有难溶性或微溶性的物质生成,则溶液中的这些离子就不能大量共存。如果溶液中的某些离子间结合有难电离的物质生成,则溶液中的这些离子之间就不能大量共存。
所谓离子共存,实质上就是判断离子间是否发生反应的问题。若在溶液中能够发生反应,就不能大量共存。判断能否发生反应,不仅是有沉淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等。
如何判断离子共存问题
1、首先在强酸性溶液中,不能大量存在弱酸根离子,也不能有大量的氢氧根;
2、在强碱性溶液中,不能大量存在弱碱金属离子,也不能大量存在氢离子及酸式根离子;
3、能发生氧化还原反应的离子也不能共存;
4、能形成络离子的也不能共存。
离子共存的判断方法
历年各地的中考试题中经常会出现物质共存离子共存的题型,离子共存题是中考化普中重现率较高的题,题型新颖、灵活。
但是虽然每年的考题在形式上常有所改变,但考查内容却变化不大。
对于物质在溶液中的共存,从实质上来讲也就是构成物质的离子间的共存。
初中部分只需掌握复分解反应中的离子共存问题,即同一溶液中如离子之间符合以下三个条件之一就会发生离子反应,离子之间便不能在溶液中共存。
(1)生成难溶物或微溶物:如SO42-与Ba2+、Ag+;OH-与Cu2+、Fe3+、Mg2+、Al3+;Ag+与Cl-、CO32-、SO32-、S2-;Mg2+、Ba2+、Ca2+与CO32-、SO32-、PO43-等不能大量共存
(2)生成气体或挥发性物质:如NH4+与OH-,H+与CO32-、HCO3-等不能大量共存。
(3)生成水:OH-与H+不能大量共存
今天化学老师给同学们分享中考化学中常见的四种离子共存的判断方法,多种离子能否共存于同一溶液中,归纳起来有四点:
一色、二性、三特殊、四反应。
如何判断离子共存
离子共存是涉及到化学问题,在考试中经常会遇到,常考的题型一般是以选择题,实验题当中的填空题,经常会当作题干条件,特别重要,今天我就把自己的经验分享给大家。
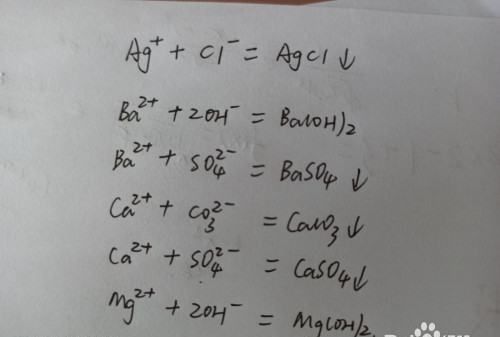
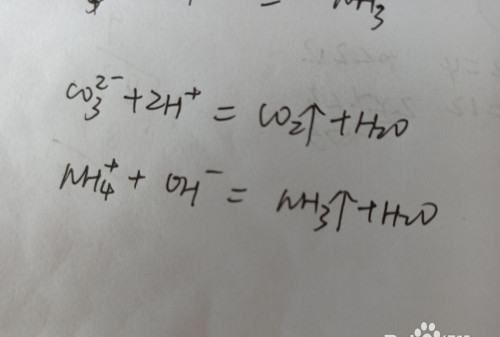
方法/步骤
离子共存:就是溶液中的离子互不反应。
判断方法:
1.看溶液是否为无色。如果溶液为浅蓝色、蓝色(铜离子)、红褐色(铁离子)、浅绿色(亚铁离子)、紫红色(高锰酸根离子)、橙色(重铬酸根离子)等颜色则溶液中的离子不能大量共存。
2.看溶液中是否含有能够生成微溶物或者是难溶物的离子。
如银离子,钡离子,锌离子,钙离子,铁离子,镁离子,硫酸根离子,大量的氢氧根离子,碳酸根离子,氯离子,亚硫酸根离子等之间能够发生复分解反应生成沉淀物的离子在一起就不能共存。
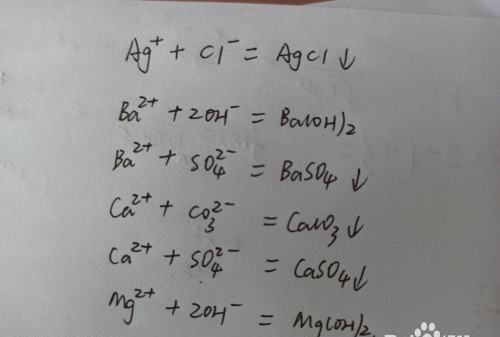
请点击输入图片描述
3.看溶液是否有气体逸出。
当溶液中含有碳酸根离子,铵根离子,碳酸氢根离子等大量存在时,离子溶液不能大量共存。
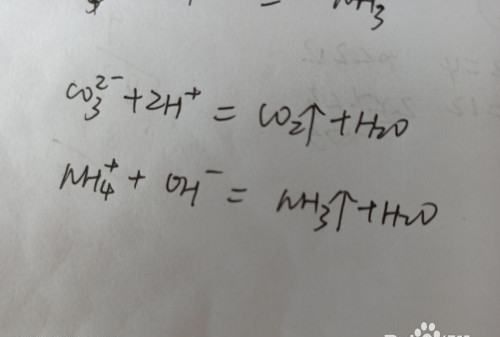
请点击输入图片描述
5
4.当溶液中含有大量的氢氧根离子和氢离子时不能大量共存。
离子能否大量共存的判断依据是什么
判断是氧化态还是还原态,然后就用氧化态的电势减还原态的电势。
它的氧化性是否高于还原性,也就是说,如果它变为低价态毕变为高价态的电势差大,就不稳定。
以Cr3+举例,它变为二价电势为-0.424,而变为六价是+1.36V,-0.424<1.36,所以它很稳定。
所谓判断一种离子稳定性,就是判断自身的,如果含有氧,那么就成了判断原电池的稳定性,或判断离子队的稳定性了。
若在溶液中能够发生反应,就不能大量共存。判断能否发生反应,不仅是有沉淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等。
扩展资料:
离子反应是向着离子减弱的方向进行,离子共存本质上是指离子能不能发生化学反应,若离子之间不能发生离子反应,则能共存。相反如果溶液中的离子之间能发生反应,则不能共存。
离子之间发生反应需要考虑许多方面的因素,如:溶液中的离子间是否有挥发性物质生成、是否有难溶性物质生成、是否有弱电解质生成等。
如果溶液中有还原性较强的离子,则溶液中不能存在较强氧化性的离子,两类离子不能大量共存。
例如:H⁺和NO₃⁻同时存在,则不能与S²⁻、Fe²⁺、I⁻共存等。
原理:H⁺与NO₃⁻结合生成的硝酸,硝酸有强氧化性与还原性较强的S²⁻、Fe²⁺、I⁻等离子发生氧化还原反应,
不能共存。
以上就是关于怎么判断离子共存问题,如何判断离子共存问题的全部内容,以及怎么判断离子共存问题的相关内容,希望能够帮到您。
版权声明:本文来自用户投稿,不代表【易百科】立场,本平台所发表的文章、图片属于原权利人所有,因客观原因,或会存在不当使用的情况,非恶意侵犯原权利人相关权益,敬请相关权利人谅解并与我们联系(邮箱:350149276@qq.com)我们将及时处理,共同维护良好的网络创作环境。




