如何从溶液中得到溶质
从溶液中得到溶质的方法是结晶、蒸发、加萃取剂、盐析、醇析,溶液是由至少两种物质组成的均一、稳定的混合物,被分散的物质(溶质)以分子或更小的质点分散于另一物质(溶剂)中。
盐析是指在蛋白质水溶液中加入中性盐,随着盐浓度增大而使蛋白质沉淀出来的现象。中性盐是强电解质,溶解度大。
混合溶液的渗透浓度怎么算
溶质就是除了溶剂外,可以溶在此溶剂中的化合物。
如:氯化钠溶液,溶质就是NaCl。
如果两种溶液混合,且他们能够相互反应,这种就有三种情况。
如:CaCl2溶液与Na2CO3溶液混合。
1、如果刚好反应,CaCl2+Na2Co3=CaCO3(沉淀)+2NaCl,所得的溶液中没有氯化钙与碳酸钠了,吸有氯化钠,而碳酸钙是不溶于水的,不算溶质。最好到的溶质只有氯化钠。
2、如氯化钙过量,则反应后溶质就是氯化钙和氯化钠。
3、如碳酸钠过量,则反应后溶质就是碳酸钠和氯化钠。
如何从溶液中得到溶质
设锌的质量分数是X,硫酸锌质量为Y
Zn +```` H2SO4= ZnSO4+ H2↑
65 ```````````````````161 `` `2
51.5g×X ``````````````Y ````0.4g
(中间的点是为了对齐,请54)
列比例式求解
X=25.4% Y=32.2
溶质质量分数为:32.2/80.5=40%
因为是完全反应嘛,所以反应后,溶质就是硫酸锌,用ZnSO4质量除以溶液质量(题中已给出) 就是溶质质量分数了。
也就是说当发生反应后(一般这种题都是完全反应),生成物就是溶质了。
比如把铁放入稀盐酸中 ,完全反应 ,溶质就是FeCl2。
明白么?
怎样判断溶液中的溶质和溶剂
1.冷却热饱和溶液或者升温
2.蒸发溶剂(这个任何溶液都可用)
初中化学溶液提纯方法
物质的分离是为了得到混合物中的不同纯净物,要保持各纯净物原来的化学成分和物理状态。
而物质的提纯只是为了净化混合物中的主体物质,不需要考虑提纯后的杂质。
1.过滤
利用物质的溶解度不同,分离可溶物和难溶物,常用于固液分离。如粗盐的提纯。
主要仪器:漏斗、烧杯、玻璃棒、铁架台、滤纸。
注意事项:
(1)一贴(滤纸紧贴漏斗内壁)
(2)二低(滤纸边缘略低于漏斗口;漏斗里液面低于滤纸)
(3)三靠(倾倒液体时,烧杯口紧靠玻璃棒;玻璃棒末端紧靠三层滤纸处;漏斗下段口紧靠烧杯内壁)
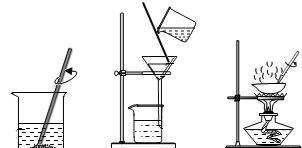
2.蒸发
利用溶液中各组分沸点的不同,加热使溶剂挥发,得到溶质的过程。常用于分离溶于溶剂中的溶质,如提取食盐中的氯化钠。
主要仪器:蒸发皿、三脚架、酒精灯、玻璃棒。
注意事项:
(1)溶质必须是不易分解、不易水解、不易被氧化的。
(2)蒸发时液体不超过蒸发皿容积的2/3。
(3)蒸发过程中应不断搅拌。
(4)接近蒸干时要停止加热,用余热加热,不要完全蒸干。
3.升华
适用于混合物中某一固体成分在一定温度下可直接变为气体,再冷却成固体的物质,如从碘和氯化钠的混合物中提取碘。
主要仪器:酒精灯、大烧杯、圆底烧瓶、铁架台、石棉网。
4.结晶和重结晶
用于分离各组分在溶剂中溶解度随温度变化而不同的混合物,如氯化钠和硝酸钾混合物的分离。
结晶和重结晶有冷却法和蒸发法两种。
主要仪器:蒸发皿、酒精灯、玻璃棒、坩埚钳、烧杯及其他过滤用仪器。
注意事项:
(1)一般先配较高温度的溶液,然后冷却结晶。
(2)结晶后过滤,分离出晶体。
5.蒸馏和分馏
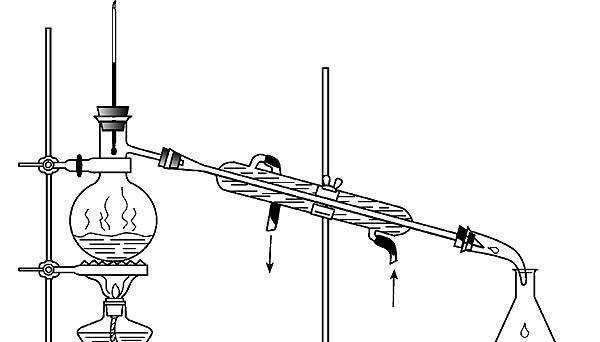
用于分离沸点不同的液体混合物,如石油的分馏。
主要仪器:蒸馏烧瓶、冷凝管、酒精灯、锥形瓶、温度计、铁架台、石棉网等。
注意事项:
(1)烧瓶中要放碎瓷片或者是沸石,以防止暴沸。
(2)温度计的水银球要在蒸馏烧瓶支管口处。
(3)冷凝管水流要下进上出。
(4)实验时先开冷水,再加热。
(5)蒸馏时不可蒸干。
6.萃取
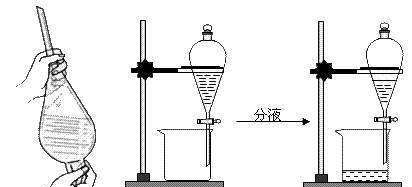
利用液体混合物中,一种溶剂在两种互不相溶的溶剂中溶解性的不同,从一种溶剂(原溶剂)中转移到另一种溶剂(萃取剂)中提取出来的过程。如用四氯化碳从溴水中提取溴。
主要仪器:分液漏斗、烧杯。
常用的萃取剂有汽油、苯、四氯化碳等。
注意事项:
(1)检查分液漏斗上口活塞是否漏水。
(2)分液漏斗中的液体总量不超过其容积的3/4。
(3)上层液体从上口倒出,下层液体从下口放出。
以上就是关于如何从溶液中得到溶质,混合溶液的渗透浓度怎么算的全部内容,以及如何从溶液中得到溶质的相关内容,希望能够帮到您。
版权声明:本文来自用户投稿,不代表【易百科】立场,本平台所发表的文章、图片属于原权利人所有,因客观原因,或会存在不当使用的情况,非恶意侵犯原权利人相关权益,敬请相关权利人谅解并与我们联系(邮箱:350149276@qq.com)我们将及时处理,共同维护良好的网络创作环境。