如何判断溶液中水的电离程度
判断溶液中水的电离程度的方法是:首先考虑温度因素,温度越高,水的电离程度越大,其次考虑溶液中溶质的性质,由于一定温度下的水的离子积是一个常数,所以加入酸、碱会抑制水的电离,而加入弱酸强碱盐或强碱弱酸盐会加强水的电离。
电离(Ionization)是指在能量作用下的原子、分子形成离子的过程,电离大致可细分为两种类型,分别是连续电离(sequentialionization)和非连续电离(Non-sequentialionization),在经典物理学中,只有连续电离可以发生。
盐溶液中水电离出的氢离子和氢氧根
强酸弱碱盐和强碱弱酸盐的水溶液中,由于盐电离出的阳离子或阴离子与水电离出来的OH-或H+结合成为弱碱或弱酸,此时促进了水的电离,从而使整个溶液显酸性或碱性。现在以Na2CO3为例分析如下:第一步:在水溶液中CO32-由于结合H+而发生水解,促进水的电离使溶液显碱性,即溶液中OH-离子浓度较大——比如设为10^-4,即pH=10。第二步:而当再加水稀释后,可以直接推断出整个溶液的碱性减弱了,即pH<10、OH-离子浓度<10*-4——>而OH-是水电离出来的,由此推断出:水的电离度减小了。
化学怎么判断溶液的电离程度与水解程度的关系
电离度是指一种盐溶液的水溶液中,水将它们电离成阳离子和阴离子的能力。水解程度是指这种盐溶液中弱离子与水结合,形成相应的弱酸或者弱减的能力,或者对于双水解的盐溶液的水溶液中,形成弱酸的强弱和形成弱减的能力强弱。对于强酸和强碱,电离度越大对应的酸碱性就越强,而它们的水解程度就越弱。对于一些易溶性的盐类来说,电离度越大对应的电离出的离子越多,而它们的水解程度就越弱。一般,电离度大的,它们的水解程度就越弱,相反,电离度小的,水解程度就越大。一般,在比较有酸式酸根离子的酸或盐的溶液中的离子浓度大小的时候就要注意,它们的电离程度和水解程度。
具体要查表
如何判断水的电离程度大小
任何溶液中,水自身电离出来的氢离子浓度=水自身电离出来的氢氧根离子浓度。
水的电离就是
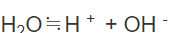
而在酸性溶液中,只有水电离出来的氢氧根,所以溶液中总的氢氧根即由水电离出的氢氧根,所以水电离的氢离子浓度等于溶液中氢氧根离子的浓度。
扩展资料:
影响水电离的因素:
1、温度。升温总是促进水的电离
2、酸和碱总是抑制水的电离。
3、能水解的盐,盐类(除酸式盐之外)总是促进水的电离,
4、活泼金属。因为活泼金属总是与水电离出的氢离子反应,使氢离子浓度减小,所以总是促进水的电离。(升温促电离,稀释促电离,水解促电离)
电离和水解程度大小的判断
【1】判断电离程度。
强电解质完全电离,弱电解质电离不完全。
①几乎所有的盐都是强电解质,都完全电离。除一些弱电解质盐hgcl2
,pb(ac)2,部分氰酸盐
②强酸完全电离,弱酸部分电离。且酸性越弱表明电离程度。
常见不完全电离的酸排序:
hio3
>
h2co4
>
h2so3
>
hso4-
>
h3po4
>
hno2
>
hf
>
hc2o4-
>
hac
>
h2co3
>
hso3-
>
h2po4-
>
h2s
>
hclo
>
hcn
>
hco3-
>
hpo4^2-
>
hs-
越靠前的酸电离度越大(以一级电离为准),可认为碘酸几乎完全电离,hs-几乎不电离。
③强碱全部电离,弱碱部分电离。
常见不完全电离的碱排序:
fe(oh)2
>
fe(oh)3
>
cu(oh)2
>
nh3*h2o
>
al(oh)3
被溶解的部分,fe(oh)2电离程度最大,al(oh)3的电离程度最小。
【2】判断水解程度
弱电解质在水溶液中都会水解,且离子对应酸的酸性越强,或对应碱的碱性越强,则该离子水解程度越大。换言之,【水解程度和电离程度正好相反】,电离程度越大,水解程度就越小;电离程度越小,则水解程度越大。
对应【1】中各种酸。
有:
弱酸根离子水解程度:io3-
<
hco4-
<
hso3-
<
so4^2-
<
h2po4^-
<
no2-
<
f-
<
c2o4^2-
<
ac-
<
hco3-
<
so3^-
<
hpo4^2-
<
hs-
<
clo-
<
cn-
<
co3^-
<
po4^3-
<
s^2-
即s^2-水解程度最大,这也是为什么na2s的水溶液显强碱性的原因。
对应【1】中各种碱。
有:
弱碱阳离子水解程度:fe^2+
<
fe^3+
<
cu^2+
<
nh4+
<
al^3+
【3】同时有水解和电离。
这种情况只考虑【多元酸的酸式酸根】,现阶段只需要记忆,因为判断酸式酸根的水解程度和电离程度哪个大需要用到酸常数和碱常数。(没有数据)
把【1】中的多元酸的酸式酸根找出来,排序:
hso4-
>
hc2o4-
>
hso3-
>
h2po4-
>
hco3-
>
hpo4^2-
>
hs-
h2po4-显弱酸性,表明h2po4-的电离程度比水解程度大。
以h2po4-为界,hso4-
,hc2o4-
,
hso3-
,h2po4-
的电离程度都比水解程度大,与强碱阳离子形成的酸式盐的水溶液显酸性,且越排在前面的离子形成的溶液酸性越强。
如:nahso4是强酸溶液。
而hco3-,hpo4^2-
,hs-
的电离程度都比水解程度小,与强碱阳离子形成的酸式盐的水溶液显碱性。且越排在后面的离子形成的溶液碱性越强。
如:nahs是强碱溶液。
【注意】:【3】中不是说除了酸式酸根离子就不能水解和电离同时发生,比如so3^2-
,水解得到的hso3-
和h2so3
肯定也会有部分电离成so3^2-
,hso3-
,但是由于hso3-和h2so3都是由so3^2-水解得来,不可能完全电离变回so3^2-
那么,最终一定是表现为so3^2-水解,即so3^2-的水解程度一定大于电离程度
再如:hclo
,电离程度非常小,而clo-的水解程度很大,但是溶液中的clo-是由hclo电离得来的,水解程度再大,也不可能全都水解变回hclo,最终一定会有部分hclo电离,所以hclo表现出弱酸性。
以上就是关于如何判断溶液中水的电离程度,盐溶液中水电离出的氢离子和氢氧根的全部内容,以及如何判断溶液中水的电离程度的相关内容,希望能够帮到您。
版权声明:本文来自用户投稿,不代表【易百科】立场,本平台所发表的文章、图片属于原权利人所有,因客观原因,或会存在不当使用的情况,非恶意侵犯原权利人相关权益,敬请相关权利人谅解并与我们联系(邮箱:350149276@qq.com)我们将及时处理,共同维护良好的网络创作环境。