怎么判断元素在周期表的位置
判断元素在周期表的位置可以用区间定位法,首先,要牢记各周期对应的0族元素的原子序数,从第1周期到第7周期0族元素的原子序数依次为2、10、18、36、54、86、118;其次,要熟悉元素周期表中每个纵行对应的族序数;具备了这些知识,便可进行推断元素在周期表的位置。
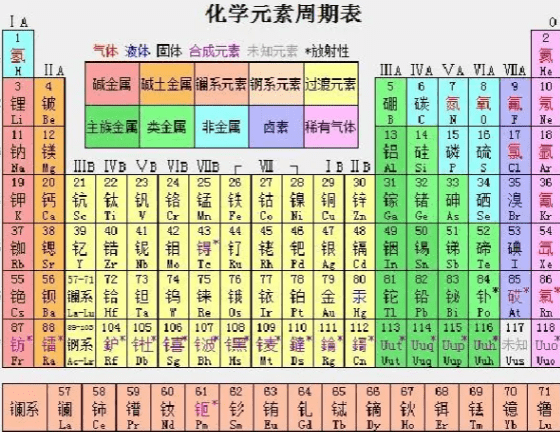
化学元素周期表是根据核电荷数从小至大排序的化学元素列表。列表大体呈长方形,某些元素周期中留有空格,使特性相近的元素归在同一族中,如碱金属元素、碱土金属、卤族元素、稀有气体等。这使周期表中形成元素分区且分有七主族、七副族、Ⅷ族、0族。
如何根据原子结构示意图判断元素在周期表中的位置
记住零族元素的位置及他们的原子序数。然后把未知元素的原子序数与零族元素相比较确定位置。如83号元素,先找与之最相近的零族元素氡(86),往前数,所以在周期表中第6周期第5主族。又如89号元素,大于86,所以在第7周期,从左到右数,确定在第三副族。也可记住每个主族的元素,然后从上到下确定相应元素在周期表中的位置。
铁在元素周期表的位置怎么判断
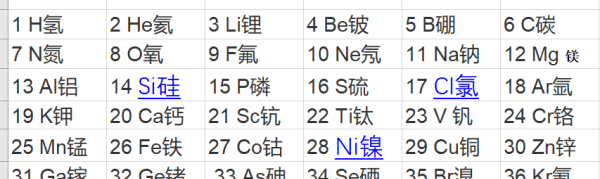
依次如下表:
元素位置推断:
根据各周期所含的元素种类推断,用原子序数减去各周期所含的元素种数,当结果为“0”时,为零族;当为正数时,为周期表中从左向右数的纵行,如为“2”则为周期表中从左向右数的第二纵行,即第ⅡA族;当为负数时其主族序数为8+结果。
所以应熟记各周期元素的种数,即2、8、8、18、18、32、32。
如:①114号元素在周期表中的位置114-2-8-8-18-18-32-32=-4,8+(-4)=4,即为第七周期,第ⅣA族。
②75号元素在周期表中的位置75-2-8-8-18-18=21,21-14=7,即为第六周期,第ⅦB族
扩展资料:元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系。
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。
同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子序数递增,元素金属性递增,非金属性递减。
同一族中的金属从上到下的熔点降低,硬度减小,同一周期的主族金属从左到右熔点升高,硬度增大。
元素周期表的意义重大,科学家正是用此来寻找新型元素及化合物。
参考资料:
如何判断一个元素的周期

判断元素位置的方法:
1、结构简图法:
本方法常用于确定原子序数小于18或已知某微粒核外电子排布的元素。其步骤为原子序数,然后原子结构简图到“电子层数等于周期数”和“最外层电子数等于主族序数”。
2、区间定位法:
对于原子序数较大的元素,若用结构简图法确定,较复杂且易出错,可采用区间定位法。其原理:首先,要牢记各周期对应的0族元素的原子序数,;其次,要熟悉元素周期表中每个纵行对应的族序数。
3、相同电子层结构法:
主族元素的阳离子与上一周期的0族元素原子的电子层结构相同;主族元素的阴离子与同周期的0族元素原子的电子层结构相同,要求掌握氦式结构、氖式结构等。
4、特殊位置法:
根据元素在元素周期表中的特殊位置,如周期表中的第1行、第1列、右上角、左下角等来确定。
元素在元素周期表的位置是由什么决定的
一、元素在元素周期表的位置由质子数和化学性质决定。
二、介绍:元素周期表有7个周期,16个族.横行为周期,纵行为族.每周期元素电子层相同,质子数逐一增加.质子数【即核电荷数】与原子序数相同.化学性质相同在同一纵行。
三、特殊注意:
1.短周期元素(前18号元素)直接靠我们初中背诵的口诀进行记忆。
2.第Ⅷ族的有3个列需要注意,第六周期和第七周期的第ⅢB族会有15个列(锕系元素镧系元素)
以上就是关于怎么判断元素在周期表的位置的全部内容,以及怎么判断元素在周期表的位置的相关内容,希望能够帮到您。
版权声明:本文来自用户投稿,不代表【易百科】立场,本平台所发表的文章、图片属于原权利人所有,因客观原因,或会存在不当使用的情况,非恶意侵犯原权利人相关权益,敬请相关权利人谅解并与我们联系(邮箱:350149276@qq.com)我们将及时处理,共同维护良好的网络创作环境。