为什么不能将水倒入浓硫酸中
不能将水倒入浓硫酸中是因为浓硫酸遇水会产生大量的热量,容易导致液体沸腾飞溅而发生危险。
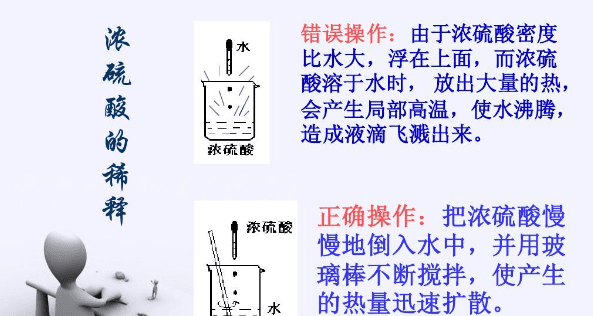
浓硫酸溶于水时放出大量的热,如果把水倒入浓硫酸中,由于水的密度(1g/cm3)比浓硫酸的密度(1.84g/cm3)小,会浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅,这是非常危险的。
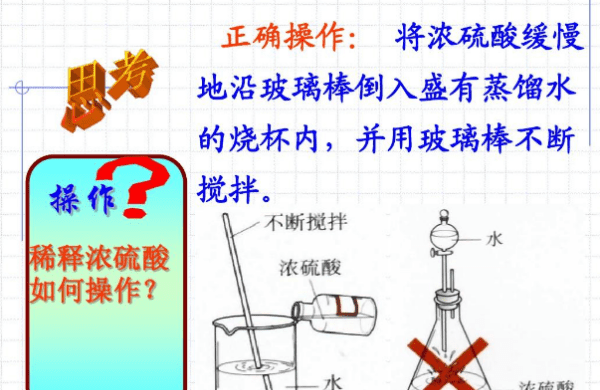
浓硫酸的稀释方法:将浓硫酸沿着器壁慢慢注入水里,并用玻璃棒不断搅拌,使热量及时散失。
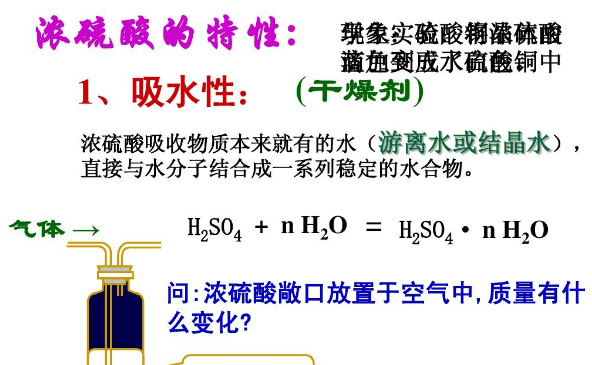
浓硫酸,俗称坏水,化学分子式为H?SO?,是一种具有高腐蚀性的强矿物酸。坏水指质量分数大于或等于70%的硫酸溶液。浓硫酸在浓度高时具有强氧化性,这是它与普通硫酸或普通浓硫酸最大的区别之一。同时它还具有脱水性,强氧化性,强腐蚀性,难挥发性,酸性,吸水性等。
一般来说密度为1.84g/mL的硫酸叫浓硫酸(注:一般认为浓度70%以上硫酸的叫浓硫酸)其中折合含SO3的量达到82%,它的浓度为18mol/L,中等浓度的是指密度在1.5到1.8左右,它们的浓度分别是在9.2mol/L到16mol/L。
为什么不能将水倒入浓硫酸中
将水倒入浓硫酸中会造成剧烈的反应,产生大量的热量和可能产生气体。这是由于浓硫酸和水之间的反应性。
科学上所说的危险包括:
1. 热反应:浓硫酸和水之间的反应是一个放热反应,会释放大量的热能。由于热能释放速率很快,可能引发激烈的热反应,导致溅射和喷溅,造成烫伤和其他伤害。
2. 溅射和喷溅:由于反应产生的气体和热量可能造成液体剧烈沸腾和气体冒泡,导致液体溅射和喷溅。这会使硫酸和水混合更加剧烈,增加危险性。
3. 气体生成:浓硫酸和水反应还会生成硫酸蒸气,这是一种有毒气体。硫酸蒸气可以刺激呼吸道和眼睛,引起不适和健康问题。
由于这些危险性,将水倒入浓硫酸中是非常危险且不应该尝试的。在进行化学实验或操作时,必须严格遵循安全操作规程和使用适当的防护措施。如有需要,在安全环境下,可以逐步将少量浓硫酸加入水中,而不是将水倒入浓硫酸中。这样可以减少危险,并确保操作的安全性。
为什么稀释浓硫酸时不准将水往浓硫酸里倒呢
因为浓硫酸遇水会产生大量热,所以必须把浓硫酸缓慢加入水中,搅拌均匀,散热后,再继续加入,如果反过来把水加入浓硫酸中,同样产生大量热,又不能散热,必然发生事故,危险,切记!
为什么不能将水倒进浓硫酸里稀释
将水倒入浓硫酸中会引发严重的危险,这是因为硫酸与水反应产生剧烈的放热反应。这个过程涉及到两个重要的科学原理:酸碱中和反应和放热反应。
当浓硫酸与水混合时,硫酸会从它的分子中释放出氢离子(H+),而水分子也会解离为氢离子(H+)和氢氧根离子(OH-)。由于硫酸是强酸,而水是中性物质,所以在反应中产生的氢离子会和水中的氢氧根离子结合,形成了大量的热能。
这个反应会迅速放出大量热量,造成溶液的温度迅速上升,甚至可能沸腾。由于硫酸是一种强氧化剂,它也会与有机物质和其他可燃物质发生剧烈反应,引发火灾或爆炸。
主要的危险包括:
1. 高温:放热反应会导致溶液迅速升温,可能造成溅溢和喷射,导致严重的烫伤。
2. 喷溅:由于反应释放的气体可能迅速推动溶液喷射,导致人员和周围环境受损。
3. 爆炸:在不恰当的条件下,反应产生的氢气可能在空间中积聚,形成爆炸性的混合物。
4. 腐蚀性:浓硫酸本身已经是一种强腐蚀剂,当与水反应后,生成的硫酸溶液会对许多材料和生物组织造成严重腐蚀。
因此,从安全角度来看,永远不要将水直接倒入浓硫酸中。正确的做法是将硫酸缓慢地加入水中,搅拌溶解,以控制反应速率和释放的热量。这个过程称为"加酸加水,永远别倒反",目的是确保安全地处理强酸和水的混合。
为什么不能将水倒入浓硫酸中稀释
将水倒入浓硫酸中会产生剧烈的化学反应,并引发严重的如下安全危险:
1. 剧烈的放热反应:浓硫酸与水反应是一个高度放热的反应,会迅速释放大量热能。这可能导致溶液剧烈沸腾、喷溅和喷射,造成烧伤和灼伤。
2. 喷溅和喷射:当水与浓硫酸反应时,溶液会迅速变热,产生大量的蒸汽和气体。这可能会导致溶液剧烈喷溅或喷射出来,带有酸性物质,造成周围环境和人体组织的损伤。
3. 腐蚀性:浓硫酸是一种强酸,对许多物质都具有强烈的腐蚀性。当水与浓硫酸反应时,会生成硫酸,并释放出大量的氢气。硫酸可以引起严重的皮肤灼伤和眼部损伤,而氢气可能具有爆炸性。
4. 气体释放:浓硫酸与水反应会释放出大量的有毒气体,如二氧化硫。这些气体具有强烈的刺激性,并可能对呼吸系统和眼睛造成伤害。
因此,绝对不要将水倒入浓硫酸中或者尝试类似的实验。如果不慎发生这种情况,应立即离开该区域,如果受伤,并向专业人员或急救人员寻求帮助。
浓硫酸具有强烈的亲水性(hygroscopicity),这是导致它可以干燥氢气(H2)和氧气(O2)的原因:
1.对于氢气(H2):浓硫酸与水反应形成硫酸,同时释放出大量的热能。这个反应是一个剧烈的放热反应,因此浓硫酸可以迅速将水分子从氢气中吸收,使氢气变得干燥。
2.对于氧气(O2):浓硫酸也可以通过吸收空气中的水分子,从而干燥氧气。由于浓硫酸对水具有很强的亲和力,当氧气通过浓硫酸中时,其中的水分会被硫酸吸附,从而使氧气失去水分而变得干燥。
如果要将水倒入浓硫酸中,请注意如下:
1.安全第一:确保在全面了解实验的安全性和操作方法之后,穿戴适当的个人防护装备如防护眼镜、实验室外套、手套等。
2.寻求专业指导:对于化学实验,最好在经验丰富的化学教师、研究员或专业实验室的指导下进行,他们可以提供必要的安全建议和操作指导。
3.了解材料和实验条件:在进行任何化学实验之前,确保充分了解所使用的化学品的性质、反应条件、安全操作要点以及应急处理措施。
4.实验环境和设备:在进行化学实验时,确保操作环境通风良好,并配备相应的实验器材和设备,如防护罩、试剂瓶等。
5.紧急处理准备:在进行实验之前,了解应急处理程序,并配备相应的应急处理设备和材料,如酸碱中和剂、安全淋浴器等。
以上就是关于为什么不能将水倒入浓硫酸中的全部内容,以及为什么不能将水倒入浓硫酸中的相关内容,希望能够帮到您。
版权声明:本文来自用户投稿,不代表【易百科】立场,本平台所发表的文章、图片属于原权利人所有,因客观原因,或会存在不当使用的情况,非恶意侵犯原权利人相关权益,敬请相关权利人谅解并与我们联系(邮箱:350149276@qq.com)我们将及时处理,共同维护良好的网络创作环境。



