电子数怎么看
对于原子来说:电子数和质子数就是看几号元素。比如H是1号元素,就含有1个电子,1个质子。
中子数要知道质量数。如果还没学到这里,质量数可以简单的认为是相对原子质量,中子数=相对原子质量减去质子数。比如O是8号元素,就有8个电子和8个质子。相对原子质量16,中子数=16-8=8
对于离子来说,质子和中子是同上面完全一样,电子有变化,得到变多,失去变少。方法差不多。
原子的核外电子数=原子序数=核内质子数=核电荷数(离子的核外电子数=原子序数(之和)-所带电荷数)
各电子层最多容纳的电子数目是2n^2(n为电子层序数)。最外层电子数目不超过8个(K层为最外层时不超过2个)。次外层电子数目不超过18个,倒数第三层电子数目不超过32个。
核外电子总是尽先排布在能量最低的电子层里,然后再由里向外,排满了L层才排M层。以上四条规律是相互联系的,不能孤立地理解。
怎么计算价层电子数
1.数出中心原子的价电子数
2.根据分子式知道总共有几个σ键,用掉了几个中心原子的价电子
3.算算总共有几个电子对在中心原子身边,包括孤对电子,共用电子对(一个σ键是一个共用电子对)
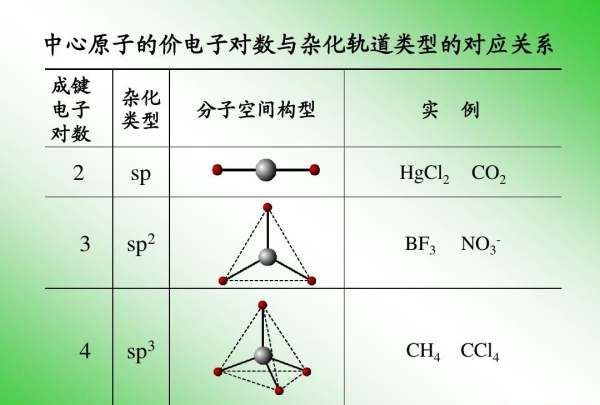
6个--八面体
5个--双三角锥
4个--四面体
3个--平面三角形
2个--直线
这是原形,如果中心原子有孤对电子,就把他填入原本键结该有的位子,而产生形状的改变
Ex:H2O
有4对电子,所以原形是四面体,但是O上面有两个孤对电子,所以占掉四面体的两个位子,变成折线形,角度接近109.5度(四面体的角度)
如果中心原子为过渡金属原子,就要像你讲的用轨域混成来探讨
sp--直线
sp2--平面三角
sp3--四面体
dsp2--平面四边
dsp3--双三角锥
d2sp3--八面体
1.写出中心原子的电子组态
2.判断出中心原子的d轨域空轨域数(也就是他原本的d电子就不用理他,我们只要没被填到的)
3.数配基供献了几个电子对作为键结之用
4.从d开始填,填完了填s,然后p
其中最麻烦的是4配位的,因为可能是dsp2或sp3
比如两价的Ni(CN)4(2-),Ni的价电子组态是d8s2,d轨域还可以塞一对电子,所以是dsp2混成,形状为平面四边形,
但同样中心金属是+2价的的Ni(CO)4(2+),价电子组态也是d8s2,却会变成sp3混成,形状是正四面体,这是因为配基的能力不同,简单来说,越是拉电子基,就越容易是dsp2混成,CN是个很强的拉电子基
其他配位数的数配基就差不多猜得出来了
如何确定中心原子的价层电子对数的大小
中心原子的价层电子对数(注意可不是价电子数)=中心原子孤电子对数+中心原子与周围原子形成σ键电子对数.
(1)先找到中心原子,一般为化合价数值较大,结合原子较多,电负性较小(除H外)。
(2)看中心原子在哪一主族,族序数也就是最外层电子数。
(3)再看和中心原子结合的原子所需电子数(8-其族序数)。
(4)中心原子的最外层电子数减去周围原子所需电子总数,再除以2就是中心原子的孤电子对数。
(5)数数周围有几个原子和中心原子结合,中心原子与周围原子形成σ键电子对数就是几。
写出结构式,该原子连接两个或两个以上原子,就属于中心原子,该原子只连一个原子,就不是中心原子。如有机物中氢肯定不是中心原子,它只能形成一个键,永远在端点上。一个分子中可能有多个中心原子,如甲醇中,碳、氧均可看作中心原子。
扩展资料:
下面以CO₂为例说明一下,首先确定中心原子为C,然后知道C是第IVA族元素,C原子最外层电子数为4,减去两个O原子成键所需电子数(每个O需要8-6=2电子,两个O共需2×2=4电子),也就是4-4=0,说明C原子没有孤对电子,而要与两个O结合需要σ键2个,C原子的价层电子对为0+2=2。
中心C原子是sp杂化,VSEPR构型和分子构型均为直线型。
再如H₂O,中心原子是O,O属第VIA族,最外层电子数为6,减去两个H需要的电子数(由于基态H原子只有1s能级,再有一个电子就可稳定)6-2×1=4,O的孤对电子数就是4÷2=2。
加上要与两个H形成两个σ键,O的价层电子对数为2+2=4。中心原子O是sp3杂化,VSEPR构型为四面体,分子构型忽略孤对电子是V形。
价电子对数计算:
(1)价电子对数=成键电子对n + 孤电子对m;
(2)成键电子对n=与中心原子成键的原子个数;
(3)孤电子对m=(中心原子价电子数-与中心原子结合的原子未成对电子数和)/2;
(4)阳离子在分子上减去所带电荷数 阴离子在分子上加上所带电荷数。
对于ABm型分子,若价电子对数与配位原子数目相等,则分子的空间构型与杂化轨道的空间构型相同。
若价电子对数与配位原子数目不等,则中心原子的孤电子对影响分子的空间构型。
含碳原子轨道杂化方式的判断
看中心原子有没有形成双键或叁键,如果有1个叁键,则其中有2个π键,用去了2个p轨道,形成的是sp杂化;如果有1个双键则其中有1个π键,形成的是sp2杂化;如果全部是单键,则形成的是sp3杂化。即:每个碳原子的杂化轨道数=碳原子所成的σ键数。
以上就是关于电子数怎么看,怎么计算价层电子数的全部内容,以及电子数怎么看的相关内容,希望能够帮到您。
版权声明:本文来自用户投稿,不代表【易百科】立场,本平台所发表的文章、图片属于原权利人所有,因客观原因,或会存在不当使用的情况,非恶意侵犯原权利人相关权益,敬请相关权利人谅解并与我们联系(邮箱:350149276@qq.com)我们将及时处理,共同维护良好的网络创作环境。