氯化铝为什么是共价键
因为铝电荷高,半径小,所以极化力较强,使得它与氯的化学键为共价键。
另外Al?Cl?分子中严格来说没有配位键,是三电子两中心的氯桥键。
从价键理论的观点(价键理论要求两个原子之间通过各自提供一个满足要求的原子轨道的重叠来形成共价键)看,氯桥键属于共价键范畴。
所以Al?Cl?是共价化合物。
AlCl?是共价化合物,在气态时是双聚分子,化学式为Al?Cl?,氯化铝其中一个氯和和另一个氯化铝中的铝形成配位键,每个铝周围都达到8个电子:这是因为离子键是正负电荷的吸引,共价键是电子云的重叠。
氯化铝为什么是共价键不是离子键
Al3+电荷高,半径小,与Cl所成键键长短,键能高,因此为共价键,AlCl3为缺电子化合物,易接受电子,因此气态为二聚体,结构如下,中间的两个Cl分别与另外的Al配位
Cl Cl Cl
\ / _\| /
Al Al
/ |\- / \
Cl Cl Cl
alcl3为什么是共价化合物图片
原因如下:
因为alcl3中不存在孤立的铝离子和氯离子,而是存在Al与Cl的共价键与配位键,所以氯化铝是共价化合物。而共价化合物是通过共用电子构成的共价键结合而成的化合物。由于AlCl3中存在Cl上的孤对电子向旁边的Al进行配位,故AlCl3以多聚体的形式存在(AI2CI6 ),形成共价化合物更稳定。
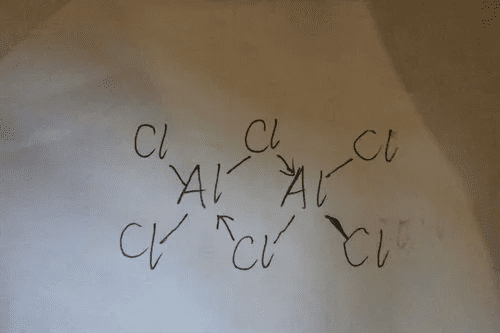
ALCL3的物化性质:
氯化铝,白色结晶性粉末,有强盐酸气味,工业品呈淡黄色。易溶于水、醇、氯仿、四氯化碳,微溶于苯。熔化的氯化铝不易导电,和大多数含卤素离子的盐类(如氯化钠)不同。氯化铝的水溶液完全解离,是良好的导电体。
氯化铝在178℃升华,它的蒸气是缔合的双分子。在空气中能吸收水分,一部分水解而放出氯化氢。
以上内容参考:
为什么氯化铝是共价键而氟化铝是离子键
因为铝电荷高,半径小,所以极化力较强,使得它与氯的化学键为共价键。
另外Al₂Cl₆分子中严格来说没有配位键,是三电子两中心的氯桥键。从价键理论的观点(价键理论要求两个原子之间通过各自提供一个满足要求的原子轨道的重叠来形成共价键)看,氯桥键属于共价键范畴。所以Al₂Cl₆是共价化合物。
AlCl₃是共价化合物,在气态时是双聚分子,化学式为Al₂Cl₆,氯化铝其中一个氯和和另一个氯化铝中的铝形成配位键,每个铝周围都达到8个电子 :这是因为离子键是正负电荷的吸引,共价键是电子云的重叠。
从电负性上分析,成键的两个原子的电负性之差大于1.7的就认为是离子键,小于1.7的就认为属于共价键。Al与Cl的电负性之差都小于1.7,所以认为它们也属于共价化合物。

扩展资料:
氯化铝的工业制备:
1、金属铝法:将
锭放入密闭的氯化反应炉内,加热并通氯气进行氯化反应,生成的氯化铝升华进入捕集器,经捕集,即制得氯化铝成品;
化学反应式:2Al + 3Cl₂=2AlCl₃
2、铝氧粉法:
将一定粒度的工业氧化铝与石油焦按一定比例投入焙烧炉内混合均匀,由炉底通入空气进行焙烧。焙烧后的物料进入氯化炉,炉中通入氯气和氧气,铝氧粉在还原剂炭的存在下与氯反应。生成的气相产物经预冷、净化去捕集器,制得氯化铝成品。尾气经氢氧化钠或亚硫酸钠溶液吸收处理后排空。
氯化钡为什么没有共价键
氯化铝是共价化合物,因为铝电荷高,半径小,所以极化力较强,使得它与氯的化学键为共价键。
因为铝的电负性(1.5)和氯的电负性(3.0)的差不算很大,所以氯没有能力把铝的电子夺走.再加上洪特规则,铝的轨道空、半满、满是最稳定的。铝的3s层有两个电子(满),稳定。但3p层只有一个。铝把3s层的一个电子给(现在是半满)一个氯,另外两个氯和共用电子(氯:满,铝:半满)这样最稳定,由于3个键都是共价键,所以氯化铝是共价化合物。
以上就是关于氯化铝为什么是共价键的全部内容,以及氯化铝为什么是共价键的相关内容,希望能够帮到您。
版权声明:本文来自用户投稿,不代表【易百科】立场,本平台所发表的文章、图片属于原权利人所有,因客观原因,或会存在不当使用的情况,非恶意侵犯原权利人相关权益,敬请相关权利人谅解并与我们联系(邮箱:350149276@qq.com)我们将及时处理,共同维护良好的网络创作环境。



